Contenuto
- Elettroni per Shell
- Sub-Conchiglie
- Notazione della sotto-shell
- Forma della sotto-conchiglia
- Electron Cloud
Gli elettroni sono minuscole particelle subatomiche con una carica negativa che orbitano attorno a gusci attorno al nucleo di un atomo. Ogni guscio può essere considerato un livello di energia e ogni livello di energia deve essere pieno di elettroni prima che un elettrone si sposti verso un guscio di energia più alto. La quantità di elettroni contenuti in ciascun guscio varia e le orbite e la disposizione degli elettroni non sono come i modelli perfettamente circolari comunemente visti.
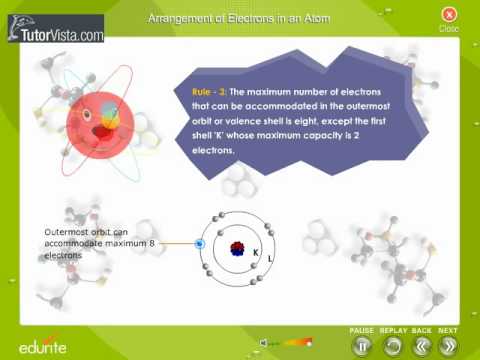
Elettroni per Shell
Ogni shell di elettroni contiene una quantità diversa di elettroni per riempire completamente la shell. Il primo guscio di elettroni può contenere due elettroni. Gli elementi idrogeno, con un elettrone, e l'elio, con due elettroni, sono gli unici elementi che hanno un solo guscio elettronico. La seconda shell può contenere otto elettroni. Il terzo guscio contiene 18 elettroni e il quarto 32.
Sub-Conchiglie
I gusci di elettroni sono ulteriormente suddivisi in sotto-gusci. Questi sotto-gusci sono considerati livelli di energia all'interno dei livelli di energia del guscio elettronico. Queste sotto-shell sono rappresentate dalle lettere s, p, d, f. Hanno un numero specifico di elettroni. Ad esempio, la sotto-shell s contiene due elettroni e la sotto-shell p ne contiene sei. Ciascuna shell secondaria è in grado di contenere quattro elettroni in più rispetto alla shell secondaria precedente.
Notazione della sotto-shell
Sotto-shell sono presenti su ciascuna delle shell di elettroni. Ad esempio, l'elemento boro ha cinque elettroni. I primi due elettroni si adattano alla prima shell sulla prima e unica sub-shell. Il secondo guscio di elettroni ha tre elettroni. I primi due si trovano sulla sotto-shell s, con un elettrone sulla sotto-shell p. Una notazione sub-shell comune per boro è 1s2 2s2 2p1. Questa notazione indica quale shell elettronica per prima di un numero, la shell secondaria per lettera e quanti elettroni sono presenti sulla shell secondaria con un numero.
Forma della sotto-conchiglia
Sebbene sia comune vedere modelli elettronici utilizzare forme circolari per visualizzare elettroni e gusci di elettroni, la forma di un'orbita è in realtà molto diversa. La sotto-conchiglia è a forma di sfera. Ogni orbitale ha la forma di un manubrio. La forma a manubrio dell'orbitale p può contenere solo due elettroni. Poiché un orbitale può contenere un totale di sei elettroni, affinché un orbitale sia pieno devono esserci tre forme di manubri che si incastrano al centro.
Electron Cloud
Gli elettroni presenti nei gusci di elettroni e nei gusci secondari non si avvolgono attorno ai gusci in un'orbita predefinita. Gli elettroni si muovono in una nuvola. Ad esempio, il livello secondario s ha due elettroni al massimo in una forma sferica. I due elettroni non ruotano attorno al bordo della sfera; possono essere presenti ovunque all'interno della forma sferica in qualsiasi momento. In effetti, secondo la fisica quantistica, gli elettroni possono uscire dalla sfera.La forma sferica del sotto-guscio s è solo il punto più probabile per localizzare gli elettroni in un determinato momento. Questo crea una nuvola di probabilità su cui l'elettrone può trovarsi in qualsiasi momento. Questo è vero per tutte le shell e le sub-shell di elettroni.