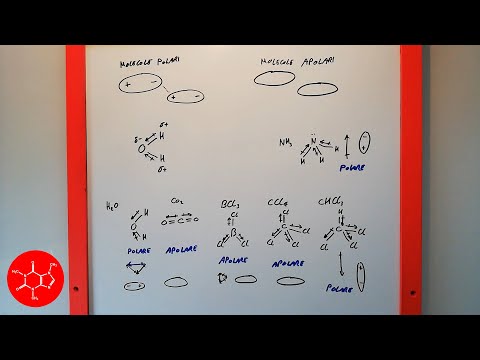
Il vecchio adagio del simile si dissolve come deriva dalla comprensione del carattere polare o non polare delle molecole. Una polarità delle molecole aumenta dall'elettronegatività degli atomi nella molecola e dal posizionamento spaziale degli atomi. Le molecole simmetriche sono non polari ma quando la simmetria della molecola diminuisce, le molecole diventano più polari. I legami covalenti condividono gli elettroni tra gli atomi con la maggior parte degli elettroni che risiedono più vicino all'atomo con l'elettronegatività più elevata.
Determina se la molecola è ionica o covalente. Le molecole ioniche sono polari se disciolte in soluzione. Le molecole ioniche rilasciano o accettano elettroni da altri atomi nella molecola.
Identifica gli atomi della molecola e i tipi di legami tra loro. Il legame covalente tra gli atomi nella molecola determinerà l'orientamento spaziale degli atomi ed è importante nel determinare le regioni di carica.
Trova l'elettronegatività relativa degli atomi nella molecola. La tendenza dell'elettronegatività aumenta man mano che ci si sposta verso l'angolo in alto a destra.
Genera una freccia lungo ciascun legame che indica l'estremità positiva e negativa del legame e la lunghezza della freccia è proporzionale alla differenza tra le elettronegatività. Questi sono i dipoli della molecola.
Accertarsi che ogni legame nella molecola sia orientato correttamente in base al legame in cui è coinvolto. I legami singoli sono orientati a 109,5 gradi nella forma di un tetraedro, un atomo a doppio legame ha legami a 120 gradi con un orientamento triangolare del triangolo e un legame triplo è una linea piana con un angolo di legame di 180 gradi. Esempi di questi sono tetracloruro di carbonio, acqua e monossido di carbonio.
Somma i singoli dipoli all'interno della molecola per determinare il dipolo complessivo della molecola. In una molecola come l'anidride carbonica, ci sono due dipoli che hanno origine nell'atomo di carbonio e puntano verso l'atomo di ossigeno.Questi dipoli sono orientati a 180 gradi di distanza e hanno esattamente la stessa grandezza, risultando in una molecola non polare. Al contrario, la molecola di acqua ha un orientamento tetraedrico con i dipoli che puntano dagli atomi di idrogeno verso l'atomo di ossigeno e che possiedono una lunghezza uguale. Esistono altri due dipoli tra l'atomo di ossigeno e le due coppie solitarie di elettroni, che puntano lontano dall'atomo di ossigeno verso gli angoli rimanenti del tetraedro. Poiché tutti i dipoli puntano in una direzione, la molecola è polare.
Classificare ogni molecola come polare o non polare in base alla dimensione del suo dipolo molecolare. Maggiore è il dipolo della molecola, più vicina è la molecola al lato polare della scala di classificazione.