Il valore K su un grafico di titolazione è Ka o Kb. Il Ka è la costante di dissociazione acida e il Kb è la costante di dissociazione base. Il grafico di titolazione rappresenta i vari livelli di pH che si verificano quando una soluzione con un pH sconosciuto viene versata in una soluzione con un pH noto. Il pH della soluzione si trova sull'asse y del grafico di titolazione e il volume della soluzione si trova sull'asse x del grafico. È utile sapere come calcolare il valore K su un grafico di titolazione, poiché tale processo viene utilizzato nella maggior parte degli esperimenti di laboratorio di chimica con acidi e basi.
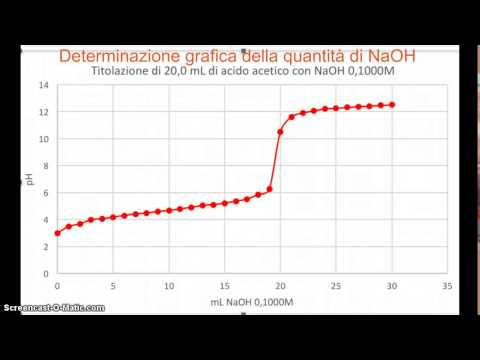
Esaminare la struttura del grafico di titolazione. Il grafico di titolazione si alza tipicamente in orizzontale, in verticale e poi di nuovo in orizzontale. Il centro della porzione verticale del grafico è il punto di equivalenza o il punto in cui il pH della soluzione sconosciuta inizia a cambiare. Ad esempio, se la soluzione sconosciuta è un acido forte e la soluzione nota è una base forte, allora il punto di equivalenza si verificherà a un pH di 7 perché dopo 7, il pH della soluzione acida diventerà basico.
Utilizzare l'equazione di Henderson-Hasselbalch per comprendere il valore di pKa nel punto di equivalenza. Il pKa della soluzione è il logaritmo negativo del Ka. L'equazione di Henderson-Hasselbalch è pH = pKa + log (/). Nel punto di equivalenza, le concentrazioni della base e dell'acido sono uguali. Il registro di 1 è uguale a 0. Pertanto, pH = pKa. Quindi a un pH di 7, il pKa è uguale a 7.
Utilizzare l'equazione per pKa per determinare il valore di Ka. L'equazione per pKa è pKa = - log (Ka). Pertanto, 10 ^ (-pKa) = Ka. Se il pKa è 7, quindi 10 ^ -7 = 1,0 x 10 ^ -7. Il valore di Ka nel grafico della titolazione è Ka = 1,0 x 10 ^ -7.