Contenuto
- Apparato di distillazione
- Grafico di distillazione semplice
- Volume vs temperatura
- Teoria della distillazione semplice
- Distillazione nell'industria
Quando fai fermentare la frutta per produrre alcol, puoi distillare la miscela liquida per isolarne parti. Questo metodo di distillazione sfrutta le diverse composizioni che compongono il liquido in un processo come la fermentazione. I chimici fanno grande uso di questi processi per purificare i solventi e altri prodotti di reazioni liquide, compresa la separazione dei componenti del petrolio greggio.
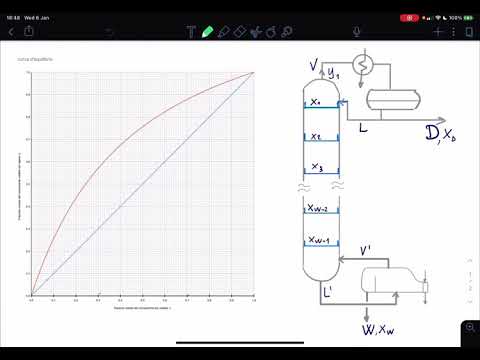
Apparato di distillazione
I grafici di distillazione mostrano le quantità misurate attraverso esperimenti di distillazione che separano i componenti di liquidi. Questi esperimenti usano colonne di distillazione frazionata costituito da una colonna che consente al liquido di gocciolare in un pallone a fondo tondo con un termometro nella parte superiore della colonna per determinare la temperatura dei vapori.
Una camera liquida diagonale si collega a un punto lungo la colonna frazionaria vicino alla parte superiore che si estende lontano dalla camera. Questo crea una superficie su cui il vapore può condensarsi e accumularsi in un pallone esterno.
Attraverso la configurazione della distillazione da un semplice diagramma di distillazione, un liquido bolle in un gas, si condensa nuovamente in un liquido e continua questo processo fino a quando il liquido che si desidera distillare si raccoglie nel pallone esterno. L'apparato funziona riscaldando il liquido che si raccoglie nel pallone in modo tale che la colonna frazionaria ti dica la pressione del vapore della forma gassosa della miscela liquida.
Il termometro in alto dovrebbe leggere il punto di ebollizione del liquido. Il pallone esterno consente al liquido di raccogliere il liquido che si desidera distillare e funge anche da sfiato in modo che l'apparato non si rompa per surriscaldamento.
Controlla la temperatura con molta attenzione massimizzando il contatto tra il liquido che gocciola di nuovo nel pallone a fondo tondo e il vapore che sale attraverso la colonna frazionaria. A volte la colonna frazionata ha perle di vetro o livelli che sporgono dai lati interni per massimizzare l'area di contatto. Tieni traccia della temperatura usando il termometro per capire la temperatura alla quale ciò accade. Dovresti finire con le pressioni di vapore dei liquidi nella miscela.
L'impostazione dell'apparato garantisce che la pressione di vapore del composto con un punto di ebollizione più basso nella miscela sia maggiore della pressione di vapore di quella con un punto di ebollizione più alto. Ciò consente anche di definire il punto di ebollizione come la temperatura alla quale la pressione del vapore è uguale alla pressione atmosferica per un liquido in un contenitore aperto. Questa è la temperatura più bassa alla quale la forma liquida della miscela o del composto bolle in un gas. Questi metodi di distillazione frazionata li rendono utili in contesti industriali per la produzione di composti chimici.
Grafico di distillazione semplice
Puoi anche usare la frazione del gas distillato come frazione molare per tracciare un grafico della temperatura del liquido, della miscela liquido-vapore e del vapore stesso per determinare il punto di ebollizione dei due o più componenti del composto . Molte configurazioni dell'apparato di distillazione misureranno automaticamente la temperatura durante il riscaldamento dell'esperimento. Questo può darti una serie continua di punti dati nel tempo che possono essere facilmente rappresentati graficamente con Excel o altri software.
La curva ti dice questo perché, quando il vapore si riscalda e passa attraverso la colonna frazionaria, dovrebbe separarsi nelle due miscele separate di liquidi e gas. Registrando la temperatura durante il processo di distillazione, è possibile capire quali sono i composti effettivamente basati sul punto di ebollizione.
Oppure puoi usare lo stesso processo per determinare il punto di ebollizione di un composto noto. Il processo è limitato, tuttavia, dalle temperature che è possibile raggiungere con la fonte di calore che influisce sul pallone a fondo tondo.
Volume vs temperatura
Il semplice grafico di distillazione dovrebbe mostrare un grafico di distillazione del volume rispetto alla temperatura della miscela con i punti in cui la temperatura di entrambi o di tutti i gas si interseca per individuare il punto di ebollizione di ciascun componente del gas. Questa curva di composizione consente di capire la configurazione e la temperatura dell'apparato appropriate per separare la miscela di gas o liquido. Puoi sperimentare diversi tipi di colonne frazionarie per capire quale ti dà l'idea più chiara di punto di ebollizione per i componenti.
Il grafico della distillazione semplice segue la teoria della distillazione semplice. Distillazione semplice significa che il gas si condensa in liquido una volta, quindi è necessario eseguirlo su liquidi o gas che hanno punti di ebollizione abbastanza distanti tra loro per discernerli.
Viene chiamato l'utilizzo di più fasi di condensazione distillazione frazionatae, in questo caso, dovrai utilizzare un grafico di distillazione frazionaria tra volume e temperatura. Puoi estrapolare per capire configurazioni teoriche per altri liquidi e miscele perché avere più perle o piastre nella configurazione dovrebbe teoricamente migliorare il metodo di separazione aumentando il tempo impiegato per separare la miscela.
Teoria della distillazione semplice
Le miscele che distillano attraverso gli esperimenti non producono campioni puri, ma provocano impurità nelle diverse miscele che misurate. Ciò significa che è possibile utilizzare le equazioni per spiegare i risultati sperimentali della distillazione e delle previsioni basate su dati precedentemente stabiliti sulla composizione di gas e liquidi. La legge di Raoults e la legge di Daltons ti danno modi di misurare queste proporzioni della semplice teoria della distillazione.
Segue la composizione precisa di quel vapore che cambia tra ebollizione e condensazione Legge di Raoults, che afferma che la tensione di vapore di un composto diminuisce quando si trova in una soluzione e può essere correlata alla composizione molare. L'equazione PUN= PoUN X χUN ti dice che la pressione parziale di un determinato componente A PUN viene prodotto per la percentuale del componente PoUN e la frazione molare di un "chi" χUN.
La pressione parziale è la pressione che avrebbe un gas costituente di una miscela se avesse l'intero volume di quella miscela alla stessa temperatura. Ciò consente di determinare la quantità di gas che deve essere presente se si conosce prima la frazione molare.
È quindi possibile utilizzare Legge di Dalton che afferma che la pressione totale di una miscela di gas è uguale alla somma delle pressioni parziali che la compongono. La teoria di come le particelle di gas si muovono e interagiscono tra loro spiega questo.
È possibile descrivere la tensione di vapore di un composto usando la temperatura della soluzione e il punto di ebollizione del composto perché, quando la temperatura aumenta, più molecole di gas avranno abbastanza energia cinetica per colpire l'un l'altro in un orientamento appropriato per lasciare che la reazione si verificano. Ne hanno bisogno per superare le forze intermolecolari che tengono insieme le particelle nella fase liquida.
Distillazione nell'industria
Oltre alla ricerca sul punto di ebollizione e sulle proprietà gassose dei composti, la distillazione si trova utile in molte applicazioni in tutto il settore. È usato nello studio e nella formazione di reazioni tra olio, acqua e altri componenti come il metano che vengono utilizzati nel carburante. Gli scienziati e i produttori di alimenti possono usarlo per produrre liquori, birra e diversi tipi di vino. Le tecniche di distillazione hanno trovato un uso pratico nelle industrie di cosmetici, farmaci e altri metodi di produzione chimica.
La tecnica viene utilizzata anche nelle lampadine per evitare che il filamento di tungsteno venga danneggiato e fornire luminosità alle lampadine. Lo fanno separando l'aria per produrre i gas necessari per fabbricare le lampadine. Questi metodi di distillazione seguono la teoria e metodi sperimentali per la separazione.